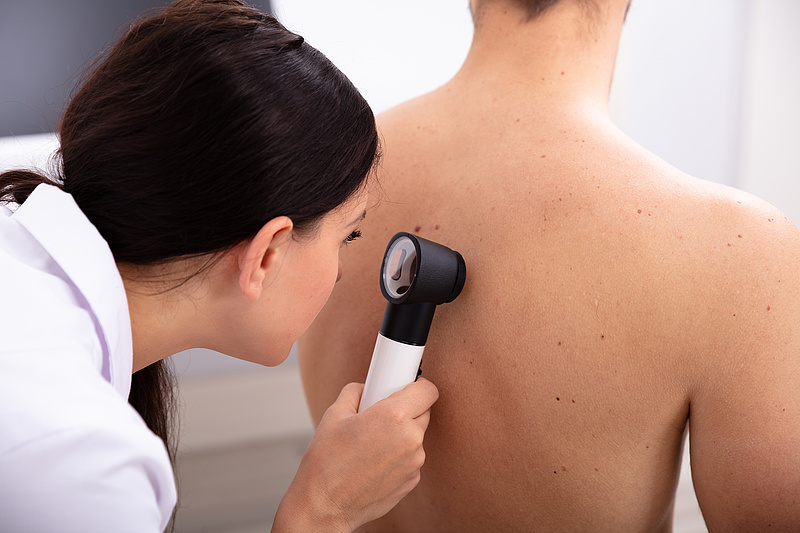
Az Európai Gyógyszerügynökség emberi felhasználásra szánt gyógyszerekkel foglalkozó bizottsága (CHMP) július közepi ülésén pozitív véleményt fogalmazott meg a melanóma kezelésére szolgáló Opdualag készítményre.
Az Opdualag 12 éves vagy idősebb felnőttek és serdülők előrehaladott - nem operálható vagy áttétes - melanómájának első vonalbeli kezelésére javallott. A készítményt kizárólag onkológus szakorvos írhatja fel - írja az Orvostovábbképző Szemle.
Az Egyesült Államok Élelmiszerbiztonsági és Gyógyszerügyi Hivatala az FDA már március 18-án engedélyezte a készítményt azonos márkanéven, a kérelmező itt a Bristol-Myers Squibb Company volt.
A vizsgálatok során az Opdualag leggyakoribb mellékhatásai a mozgásszervi fájdalom, fáradtság, kiütés, viszketés és hasmenés voltak. A leggyakoribb laboratóriumi eltérések többek között a csökkent hemoglobinszint, az alacsony limfocitaszám és csökkent nátriumszint voltak.
A melanóma agresszív rákos megbetegedés, ha időben felismerik, jól kezelhető. A daganatos betegségek között Magyarországon a negyedik-ötödik leggyakrabban előforduló ráktípus.
Statisztikai adatok szerint jelentősen emelkedett Magyarországon a melanomás betegek száma az elmúlt években. A nemzeti rákregiszter adatai szerint 2007-ben 1800, 2017-ben és napjainkban is évente háromezer új beteget diagnosztizálnak, és minden évben 360-an életüket is vesztik.
Legolvasottabb

Mintegy 1,7 milliárd forintot tüntetett el az emberek pénzéből a fideszes cég

Háborús pszichózis: már egy magyarral sem hajlandó kezet fogni az ukrán teniszező

Leállt az M3-as metró

Váratlan dolog derült ki az állampapírokról

Nem lesz kormányváltás? Két hónappal a választások előtt derült ki: a magyarokat nem érdekli a szavazás!

Brutális magyarázat! Az államtitkár kegyetlen ítéletet mondott a magyar szegénységről, Pintér Sándor hallgatott

Török Gábor: A pártok támogatottsága áprilisig változatlan maradhat

Brutálisan kilőtt az arany ára

Ez igazán fájni fog Putyinnak: onnan jön a hátba rúgás, ahonnan nem várta